在哺乳动物卵子向早期胚胎转变的过程 (oocyte-to-embryo transition, OET) 中,翻译在减数分裂、合子基因组激活和早期胚胎发育过程中扮演了一个重要的角色。合子基因组激活 (human zygotic genome activation, ZGA) 作为生命起始时的第一次转录事件和启动胚胎发育进程的关键事件,在哺乳动物中仍未被完全理解清楚。尽管启动ZGA的关键转录因子在其他物种,如斑马鱼和果蝇等中被陆续发现,启动人类ZGA的关键转录因子仍然是一个未解之谜。
2022年9月8日,山东大学生殖医学研究中心陈子江、赵涵研究团队与清华大学生命学院颉伟研究团队通过紧密合作,在《科学》期刊以长文形式报道了题为《翻译组与转录组联合图谱发现TPRX参与人类合子基因组激活》(Translatome and transcriptome co-profiling reveals a role of TPRXs in human zygotic genome activation)的研究论文,绘制了人类卵子向早期胚胎转变过程中的翻译图谱,揭示了人-鼠卵子及早期胚胎中翻译水平动态变化的差异,并鉴定出一组Homeobox转录因子,包括TPRXL, TPRX1, 和 TPRX2,是人类合子基因组激活的关键调控因子。这一重要发现不仅揭示了人-鼠早期胚胎翻译组动态变化的差异性和保守性、鉴定出了人类合子基因组激活的关键调控因子,还为将来研究人-鼠早期胚胎发育过程中生理功能的异同,以及临床评估胚胎质量和探索早期发育相关疾病提供了新的研究方向。

通过结合超灵敏翻译组测序技术Ribo-lite (Ligation-free, ultra-low-InpuT and Enhanced Ribo-seq) 和转录组测序技术 (Smart-seq2) 而开发出的Ribo-RNA-lite (R2-lite) 方法可以进行翻译组与转录组联合测序,该方法被应用于人类卵子和早期胚胎共8个时期。经翻译组分析比较发现,在卵子向早期胚胎转变过程中,人-鼠同源基因中有一半呈现保守的翻译水平动态变化趋势,而另一半呈现不同的翻译水平动态变化趋势,例如编码表观遗传重编程因子、小RNA生物学合成酶等基因。并且这种物种特异性的翻译变化是部分由于 (3’ UTR) 的关键调控序列,例如胞质多聚腺苷酸化元件 (cytoplasmic polyadenylation element, CPE) 和 多聚腺苷酸化信号位点(polyadenylation signal site, PAS) 的差异排布导致的。
人类早期胚胎翻译组数据还显示出一组Homeobox转录因子在人类合子基因组激活阶段附近呈现高翻译活性,并且它们潜在的DNA结合基序 (motif) 在ZGA基因的远端开放染色质区域(即可能的增强子)上高度富集。这些转录因子包括母源因子TPRXL以及在初级ZGA时期 (minor ZGA) 开始表达的TPRX1和 TPRX2。TPRXL的3’ UTR上也带有CPE调控元件,在卵子减数分裂恢复时开始翻译上调。 TPRX1/2/L 联合敲低 (TPRX triple KD or TKD) 将导致胚胎发育和ZGA的明显缺陷,大约31%的ZGA基因将被下调,并且这些基因富集PRD-like转录因子结合基序。TPRX1/2/L 联合敲低胚胎中表达水平下调的基因包括有多个下游转录因子如ZSCAN4, DUXB, DUXA, NANOGNB, DPPA4, GATA6, DPRX, ARGFX 以及 KLF5。在人类胚胎干细胞中,过表达TPRX1/2也可以结合并激活一部分ZGA基因,说明TPRX1/2/L可以通过靶向下游转录因子从而启动下游转录事件。综上所述,这项研究不仅揭示了人-鼠早期胚胎翻译组动态变化的差异性和保守性以及可能原因,也鉴定出了人类合子基因组激活的关键调控因子TPRXL, TPRX1, 和 TPRX2。
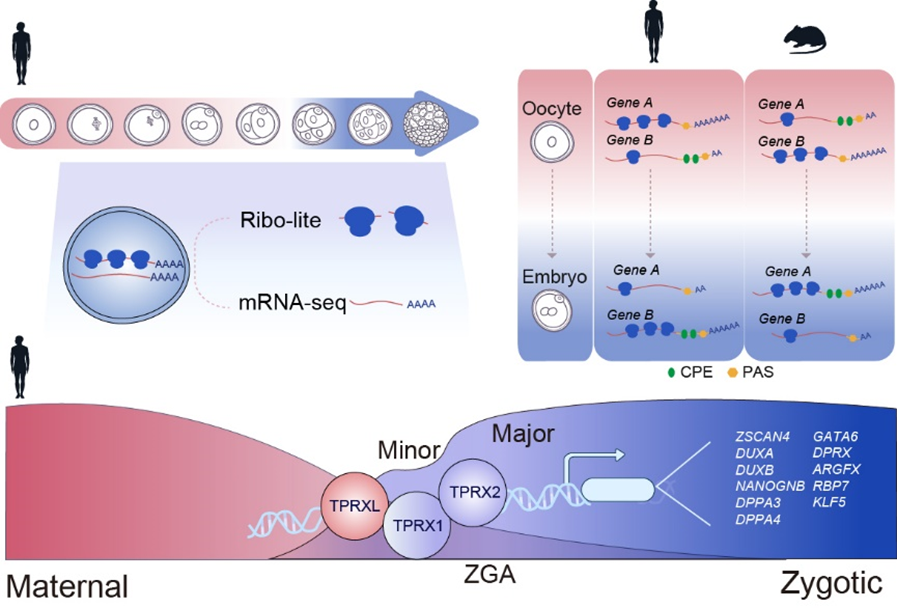
人类卵子和早期胚胎翻译组与转录组联合测序揭示翻译调控机制和合子基因组激活关键因子
清华大学颉伟教授、山东大学陈子江院士与赵涵教授为本文的共同通讯作者,清华-北大生命科学联合中心2018级博士研究生邹卓宁、山东大学生殖医学研究中心2021级博士研究生张传鑫、清华大学生命学院2020级博士研究生王秋艳以及山东大学生殖医学研究中心助理研究员侯真真为本文共同第一作者。
原文链接:https://www.science.org/doi/10.1126/science.abo7923